GIỚI THIỆU BÀI HỌC
Bài giảng Lí thuyết Amino axit trình bày các khái niệm về định nghĩa, tính chất lý hóa, ứng dụng, điều chế và các ví dụ minh họa cho từng vấn đề. Qua đó các em sẽ được ôn tập lại kiến thức, biết cách viết công thức tổng quát, cách gọi tên, nắm được cấu tạo của các hợp chất Amino axit và vận dụng vào giải các bài toán liên quan đến Amino axit.
NỘI DUNG BÀI HỌC
\(AMINO-AXIT\)
(-NH2: Bazơ)(-COOH: Axit)
I. KHÁI NIỆM:
- Hợp chất hữu cơ tạp chất, lưỡng tính.
R(COOH)x(NH2)y:
x=y: dung dịch có pH=7
x>y: dung dịch có pH<7
x7
CTPT t/q: amino axit no chứa
1- NH2 và 1-COOH
CnH2n+2+1-2.1O2N
\(\Leftrightarrow\) CnH2n+1O2N
Tên amino axit (COOH)
Axit+ số thứ tự C gắn với NH2 + amino + tên gốc axit tương ứng.
.png)
+ Số amino axit thông dụng
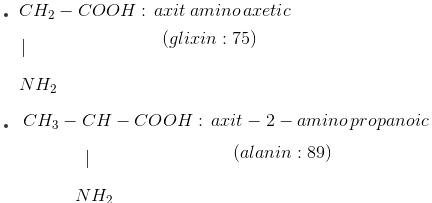
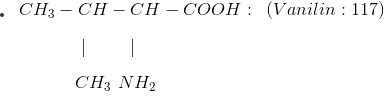
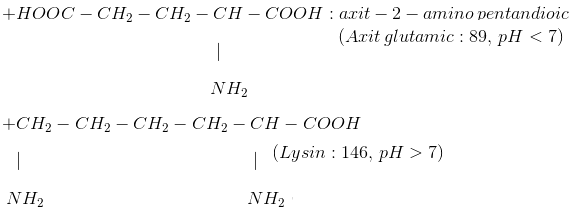
II. LÝ TÍNH:
- Chất rắn, hơi ngọt, dễ tan trong H2O.
- Tinh thể tồn tại dạng ion lưỡng cực (muối).
- Trong dung dịch tồn tại ion và phân tử.
\(H_{2}N-R-COOH\rightleftharpoons H_{3}^{+}N-R-COO^{-}\)
( phân tử) ( ion lưỡng cực)
- to sôi amino axit > to sôi axit > to sôi ancol > to amin
( cùng C)
- Trong tự nhiên tồn tại dạng \(\alpha\) chủ yếu.
III. HÓA TÍNH:
1. Tính lưỡng tính:
- Tác dụng dung dịch axit mạnh ( dung dịch HCl) và dung dịch bazơ mạnh ( dung dịch NaOH,...)
\(H_{2}\ddot{N}-CH_{2}-COOH\, +\, H^{+}Cl\rightarrow ClH_{3}N-CH_{2}-COOH\)
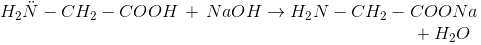
2. Phản ứng este hóa:
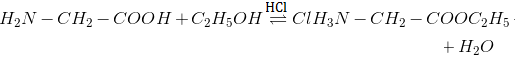
3. Phản ứng tráng gương:
- H2O được tánh OH của (-COOH) ở phân tử này. Với H của (NH2) ở phân tử kia.
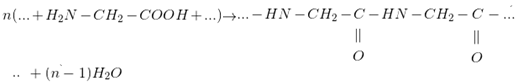
Chú ý:
R(COOH)x(NH2)y: a mol
+ Tác dụng dung dịch NaOH vừa đủ.
\(R(COOH)_{x}(NH_{2})_{y}+xNaOH\rightarrow R(COONa)_{x}(NH_{2})_{y}+xH_{2}O\)
a mol xa mol
\(\frac{n_{NaOH_{p/u}}}{n_{amino\, axit}}=\frac{xa}{a}=x\) (Số nhóm COOH)
+ Tác dụng dung dịch HCl vừa đủ:
\(R(COOH)_{x}(NH_{2})_{y}+yHCl\rightarrow R(COOH)_{x}(NH_{3}Cl)_{y}\)
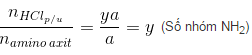
2/
.png)

\(HCl+NaOH\rightarrow NaCl+H_{2}O\)
0,05 \(\rightarrow\) 0,05 0,05 0,05
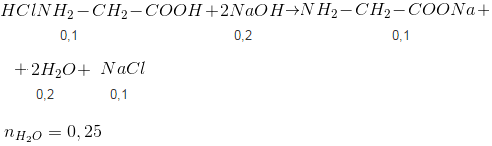
\(HCl=0,15\)
\(NH_{2}-CH_{2}-COOH: \, 0,1\)
\(H^{+}=0,15\)
Tác dụng vừa đủ: \(n_{OH^{-}}=0,15\)
Khối lượng chắc rắn sau phản ứng ?
\(\sum n_{H^{+}}=0,25\)
\(\Rightarrow n_{NaOH}=0,25\)
mchắc rắn= 0,1.74+0,15.35,5+0,25.23= ?
+ Nếu dung dịch NaOH dư: chắc rắn có NaOH dư














 Ra mắt HOC247 Kids nền tảng học tập Online #1
Ra mắt HOC247 Kids nền tảng học tập Online #1



